Groupe Inflammation, signaux de danger, infection et pathologies pulmonaires

Responsable: Isabelle Couillin
Coresponsable: Nicolas Riteau
Isabelle Couillin (IC) (CNRS, DR1) est co-directrice de l’INEM depuis 2015. IC possède une forte expertise sur la mort cellulaire et les signaux de dangers associés à l’activation de l’inflammasome dans des pathologies pulmonaires incluant la bronchopneumopathie chronique obstructive (BPCO) la fibrose pulmonaire idiopathique (FPI). IC a publié >70 articles (h-index 32; >5.2K citations).
Selon l’Organisation Mondiale de la Santé, la Broncho-Pneumopathie Chronique Obstructive (BPCO) est la troisième cause de mortalité dans le monde. L’exposition répétée à la fumée de cigarette est la principale cause de l’inflammation pulmonaire chronique et de l’emphysème pulmonaire qui est caractérisé par une atteinte irréversible de la structure des parois alvéolaires. La fibrose pulmonaire idiopathique (FPI), la plus grave des maladies pulmonaires interstitielles, est une pathologie dévastatrice caractérisée par une dérégulation des processus de réparation mis en place lors d’un dommage du tissu pulmonaire. Cela se traduit par une cicatrisation des poumons conduisant à une perte progressive de la fonction respiratoire. Les causes de la FPI restent à ce jour peu connues. Cependant cette pathologie se développe souvent chez les fumeurs et les anciens fumeurs. La FPI et la BPCO sont des maladies irréversibles et les traitements actuels ont une efficacité très limitée. Les événements
immunologiques conduisant à ces pathologies ne sont pas bien compris. Notre équipe a pour objectif de décrypter les mécanismes physiopathologiques de ces maladies. Nos recherches visent à identifier les molécules endogènes (ou signaux de danger libérés suite à un endommagement du tissu pulmonaire), leurs senseurs cellulaires et les voies de signalisation activées lors de la mise en place des réponses innée et adaptative. Nous utilisons des modèles expérimentaux murins de pathologies pulmonaires comme l’exposition de souris à la fumée de cigarette ou à d’autres polluants, ainsi que l’administration dans les voies respiratoires de bléomycine, pour provoquer une fibrose, ou de protéases afin d’induire un emphysème pulmonaire.
Nous avons identifié l’acide urique et l’ATP comme étant des signaux de danger capables d’activer l’inflammasome NLRP3, ceci conduisant à la maturation et la sécrétion de l’interleukine (IL-)1b cytokine pro-inflammatoire essentielle dans ces processus pathologiques. Nous étudions actuellement les fonctions émergentes des inflammasomes canoniques (NLRP3, NLRP6) et non canoniques, en lien avec l’influence du microbiote intestinal et pulmonaire sur l’inflammation pulmonaire. Nous analysons également le rôle des acides nucléiques du soi qui peuvent activer d’autres récepteurs intra-cytosoliques comme cGAS-STING et les voies de signalisation des interférons de type I et III. De plus, nous nous intéressons aux fonctions du facteur d’activation des cellules B (BAFF) à l’interface entre immunité innée et adaptative.
Une meilleure compréhension de la pathogenèse et des phénomènes impliqués dans ces pathologies devrait permettre d’identifier et de valider certains ligands ou récepteurs comme cibles thérapeutiques, pouvant servir de base à des tests de criblage pour sélectionner des molécules d’intérêt pharmacologique.

Publications récentes
2023
NLRP6 controls pulmonary inflammation from cigarette smoke in a gut microbiota-dependent manner
La maladie pulmonaire obstructive chronique (MPOC) est un problème de santé majeur principalement causé par la fumée de cigarette. Elle se caractérise par des difficultés respiratoires et une inflammation récurrente des voies respiratoires. NLRP6 est un récepteur qui joue un rôle dans le contrôle de l’inflammation dans les intestins et dans l’interaction entre l’hôte et le microbe intestinale. Cependant, ses fonctions dans les poumons ne sont pas bien comprises. En utilisant un modèle d’exposition à la fumée de cigarette, nous avons observé que les souris déficientes en NLRP6 présentaient une inflammation des voies respiratoires réduite avec moins de cellules inflammatoires. L’étude a révélé que l’expression de NLRP6 dans les cellules épithéliales des poumons est cruciale pour réguler l’inflammation dans les voies respiratoires et les tissus pulmonaires par le biais d’une voie spécifique. Étant donné que certaines substances produites dans l’intestin influent sur l’activation de NLRP6 dans les intestins, nous avons exploré le lien entre NLRP6, l’inflammation pulmonaire induite par la fumée de cigarette et la composition des bactéries intestinales. Les résultats ont montré que l’exposition à la fumée de cigarette modifiait la microbiote intestinale aussi bien chez les souris normales que chez celles déficientes en NLRP6. Le traitement des souris avec des antibiotiques réduisait l’inflammation pulmonaire causée par la fumée de cigarette. De plus, le transfert de la microbiote intestinale de souris déficientes en NLRP6 à des souris normales diminuait l’inflammation pulmonaire, indiquant une connexion intestin-poumon contrôlée par NLRP6 qui influence l’inflammation pulmonaire.
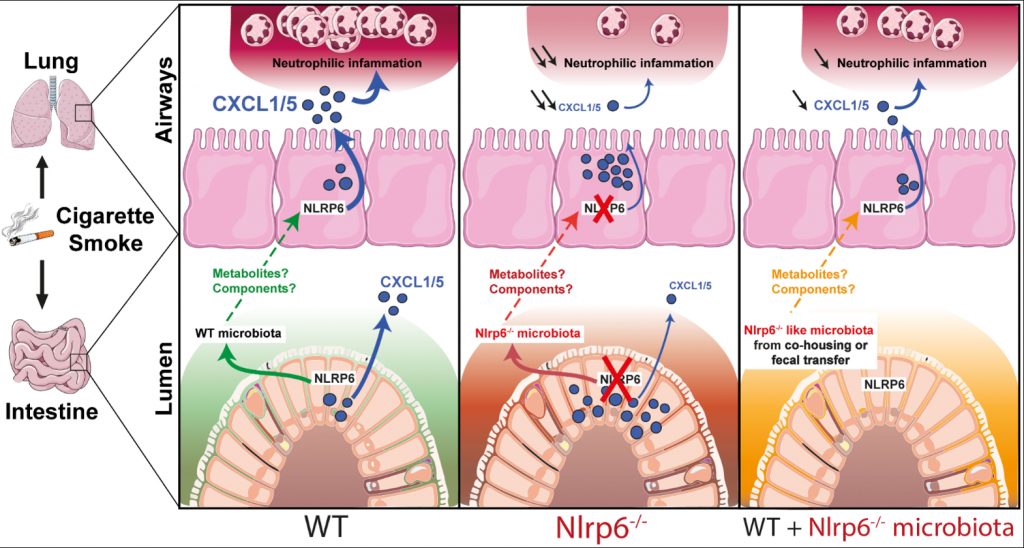
NLRP6 controls pulmonary inflammation from cigarette smoke in a gut microbiota-Dependent manner
Lung inflammation and interstitial fibrosis by targeted alveolar epithelial type I cell death
Dans cette étude, nous avons cherché à comprendre le rôle des cellules épithéliales alvéolaires de type 1 (AT1) dans les maladies pulmonaires chroniques, en particulier leur contribution à l’inflammation et à la fibrose interstitielle. Nous avons utilisé un modèle inductible en utilisant la toxine diphtérique (DT) pour spécifiquement éliminer les cellules AT1 dans une lignée de souris transgéniques (iDTR flox/flox Aquaporine 5 CRE).
Cet article montre qu’une administration répétée de DT entraîne la mort des cellules AT1, conduisant à une inflammation et à une augmentation des marqueurs de la réparation tissulaire et de la réorganisation tissulaire avec des signes de développement d’une fibrose pulmonaire interstitielle. Ces résultats suggèrent que la perte des cellules AT1 suite à des microlésions répétées pourrait représenter une nouvelle approche pour étudier les maladies inflammatoires pulmonaires chroniques telles que la fibrose pulmonaire idiopathique (FPI). Ce modèle offre des perspectives intéressantes pour l’étude des mécanismes des maladies pulmonaires et pour tester des traitements potentiels.
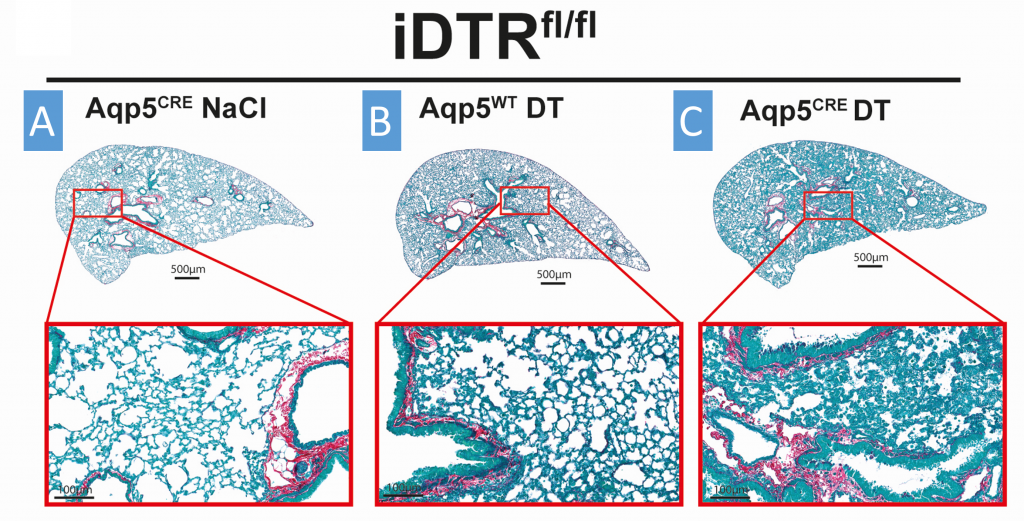
DT-induced AT1 cell ablation causes inflammatory cell recruitment at day 8. iDTRfl/fl x Aqp5CRE mice (A and C) and control iDTRfl/fl x Aqp5WT mice (B) were treated at days 0 and 2 with 10 ng of DT (B and C) or saline control (A) in the airways by oropharyngeal administration and harvested at day 8. Collagen deposition in the lungs was assessed by Red Sirius staining showing collagen fibers in purple
Lung inflammation and interstitial fibrosis by targeted alveolar epithelial type I cell death
2022
Activation de la gasdermine D induite par la fumée de cigarette dans les macrophages bronchoalvéolaires et les cellules épithéliales bronchiques en fonction de NLRP3
L’inflammation pulmonaire chronique et la broncho-pneumopathie obstructive chronique (BPCO) sont des problèmes de santé majeurs en grande partie dus à la pollution de l’air et à l’exposition à la fumée de cigarette (CS). Le rôle du récepteur inné NLRP3 (domaine de liaison aux nucléotides et répétition riche en leucine contenant la protéine 3) orchestrant l’inflammation par la formation d’un complexe inflammasome dans l’inflammation induite par le CS ou la MPOC reste controversé. En utilisant des modèles d’exposition aiguë et subchronique au CS, nous avons constaté que les souris déficientes en Nlrp3 ou les souris de type sauvage traitées avec l’inhibiteur de NLRP3 MCC950 présentaient une réduction importante des cellules inflammatoires recrutées dans l’espace bronchoalvéolaire et de l’inflammation pulmonaire avec une diminution de la production de chimiokines et de cytokines, dans notamment IL-1β démontrant le rôle clé de NLRP3. De plus, les souris déficientes en caspase-1/caspase-11 présentaient également une diminution des paramètres d’inflammation, suggérant un rôle pour l’inflammasome NLRP3. Il est important de noter que l’exposition aiguë au CS favorise le clivage dépendant de NLRP3 de la gasdermine D dans les macrophages présents dans l’espace bronchoalvéolaire et dans les cellules épithéliales des voies respiratoires bronchiques. Enfin, le déficit en Gsdmd a réduit l’inflammation aiguë des poumons et de l’espace bronchoalvéolaire induite par le CS et la sécrétion d’IL-1β. Ainsi, nous avons démontré dans notre modèle que NLRP3 et la gasdermine D sont des acteurs clés de l’inflammation pulmonaire induite par le CS et de la libération d’IL-1β potentiellement par la formation de pores de la gasdermine D et/ou la mort cellulaire pyroptoctique.
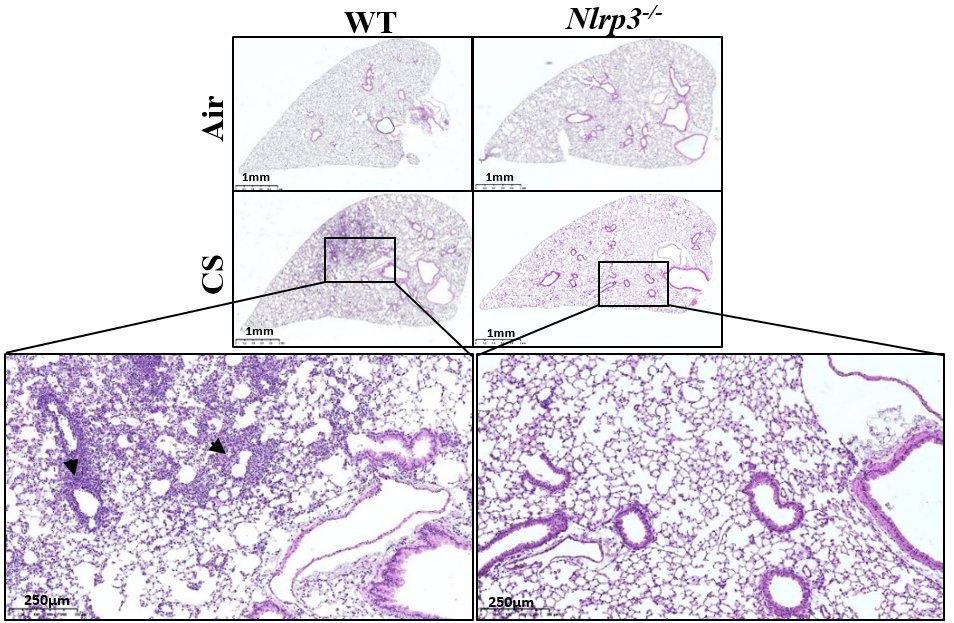
Nlrp3 deficiency decreases remodeling factor expression and lung tissue inflammation upon subchronic cigarette smoke (CS) exposure. WT and Nlrp3-/- mice were exposed to CS or Air during 6 weeks. Histological analysis of pulmonary inflammation and cell recruitment were evaluated from histology sections.
Cigarette smoke-induced gasdermin D activation in bronchoalveolar macrophages and bronchial epithelial cells dependently on NLRP3
2021
La déficience en STING conduit à une fibrose exacerbée indépendamment de la signalisation des interférons (IFN) de type I
Des souris WT, Sting-/- et déficientes pour le récepteur aux IFN de type I (Ifnar1-/-) ont été traitées avec une solution saline (NaCl) ou de l’agent inducteur de la fibrose (bléomycine, BLM 3 mg/kg intranasale) et les poumons ont été collectés après 14 jours. Les images montrent des coupes histologiques de poumons en coloration Red Sirius/Fast Green qui marque les fibres de collagènes en violet. Les rectangles rouges et bleus montrent des agrandissements et les flèches noires le dépôt de collagène.
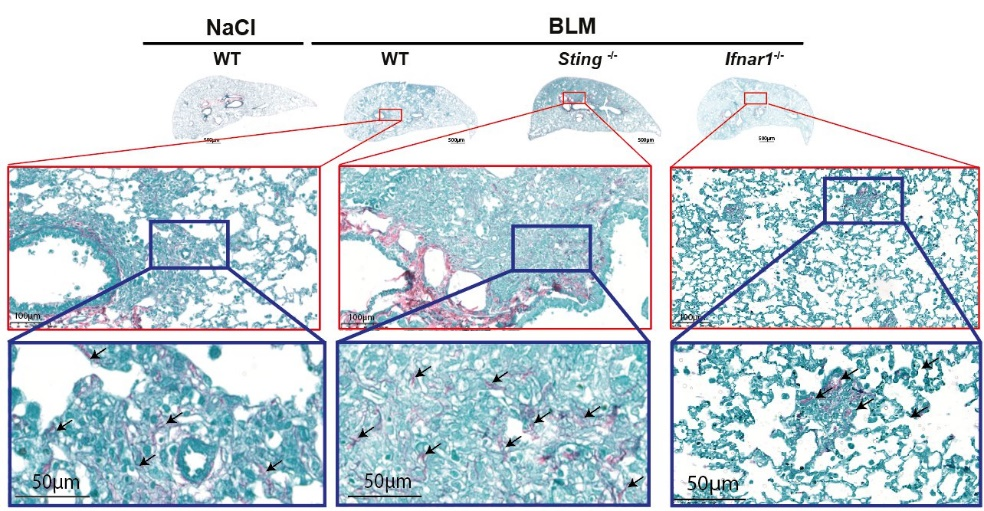
Protective Role of the Nucleic Acid Sensor STING in Pulmonary Fibrosis
2020
La sécrétion de la protéine BAFF (B-Cell Activating Factor) par les neutrophiles joue un rôle important dans l’inflammation pulmonaire consécutive à l’exposition aigue à la fumée de cigarette
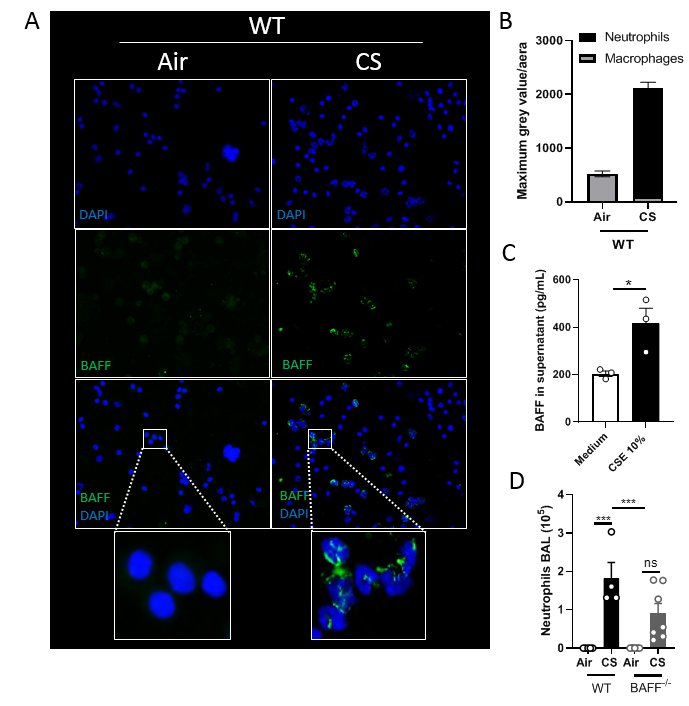
Des souris sauvages (WT) ou déficientes pour BAFF (BAFF-/-) ont été exposées à l’air ambiant (AIR) ou à la fumée de cigarette (CS) trois fois par jour pendant quatre jours et sacrifiées 16h après la dernière exposition. (A) Marquage en immunofluorescence des noyaux (DAPI, bleu) et de BAFF (vert) de cellules provenant de lavages broncho-alvéolaires (BAL) de souris WT exposées ou non à CS. Le marquage BAFF est localisé au sein de cellules polylobés (neutrophiles). (B) Quantification de l’intensité de fluorescence. (C) Dosage par ELISA de la quantité de BAFF dans le surnageant de neutrophiles issus de la moelle osseuse après stimulation par du milieu (Medium) ou de l’extrait de fumée de cigarette (CSE) (D). Diminution du nombre de neutrophiles dans le BAL de souris BAFF-/- exposées à CS par rapport au souris WT.
