Groupe Allergies, infection, stress & Immunité

Responsable: Dieudonnée Togbe
Coresponsable: Valérie Quesniaux
–
L’équipe se concentre sur l’étude des interactions complexes entre les allergies, les infections respiratoires ou le stress et le système immunitaire. Notre objectif principal est de mieux comprendre comment ces trois facteurs interagissent et s’influencent mutuellement pour impacter la santé respiratoire, intestinale et, au-delà, la neuroinflammation. Nous étudions les mécanismes immunologiques impliqués dans les réponses allergiques, les réponses de l’hôte à l’infection, et leurs exacerbations, en mettant particulièrement l’accent sur les voies liées au stress cellulaire, à la mort cellulaire, à la libération de l’ADN extracellulaire, à l’homéostasie du fer, ainsi qu’aux récepteurs clés impliqués dans ces réponses. Grâce à des approches multidisciplinaires, associant des modèles de pathologies humaines in vitro et in vivo à des analyses transcriptomiques, protéomiques et métabolomiques, l’équipe cherche à identifier et/ou valider des cibles thérapeutiques potentielles pour améliorer la prévention et le traitement des allergies, des infections respiratoires, des inflammations intestinales ainsi que les phénomènes d’exacerbations.

Au sein de l’équipe, nous nous intéressons à trois axes majeurs :
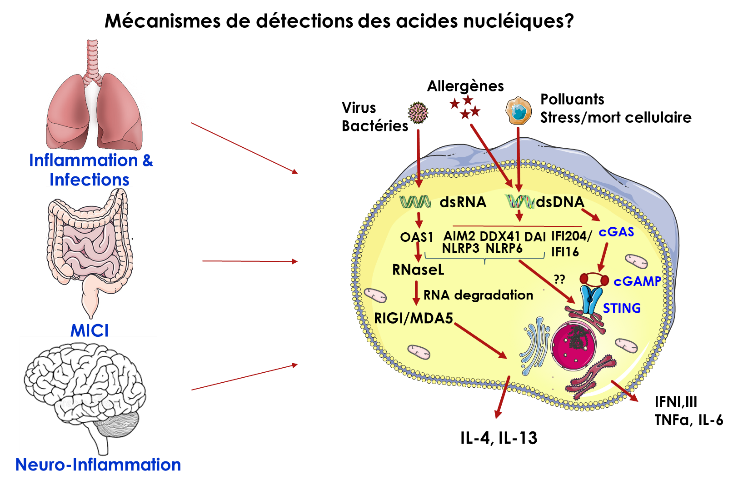
1. Mécanismes de détection des acides nucléiques (D. Togbé/V. Quesniaux)
2. Identification des métabolites, microbiote et facteurs de transcription clés (D. Togbé/V. Quesniaux/C. Mura)
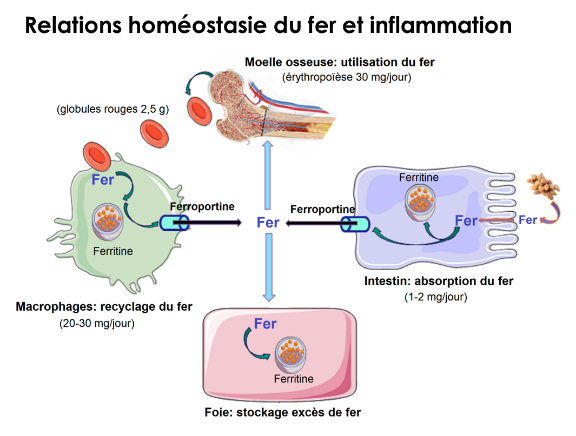
3. Relations homéostasie du fer et inflammation (C. Mura)
Ces facteurs déclenchant et ces axes de régulation contribuent aussi à induire la neuroinflammation, un thème transversal de l’unité auquel participent les différentes équipes. Nos travaux contribuent à la compréhension globale des interactions entre ces domaines, offrant des perspectives novatrices pour améliorer la santé.
Publications récentes
2022
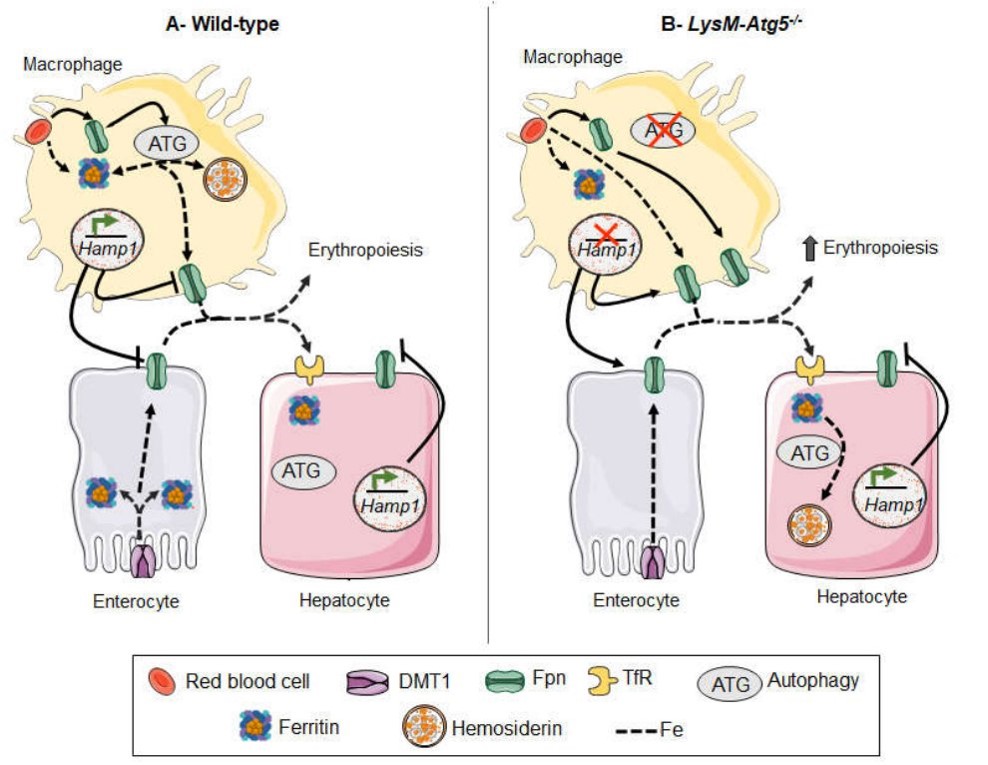
Targeted autophagy disruption reveals the central role of macrophage iron metabolism in systemic iron homeostasis
Schematic figure of key similarities and differences between WT and LysM-Atg5- /- mice. (A) Wild-type mice. Erythrocytes are phagocytosed by macrophages. Macrophages efficiently recycle phagocytosed iron to transferrin in the circulation and with the help of autophagy the excess iron is stored in hemosiderin. A small amount of iron uptake by enterocytes is released from enterocytes, most is stored in ferritin. Tranferrin-bound iron is carried to bone marrow. Iron is incorporated into newly formed erythrocytes within the bone marrow. Hepcidin produced from hepatocytes and macrophages control cell iron release. (B) LysM-Atg5-/- mice. Erythrocytes are phagocytosed by macrophages. Macrophages efficiently recycle phagocytosed iron to transferrin in the circulation but without functional autophagy ferroportin from red blood cells can not be sufficiently degraded and the excess iron can not be stored in hemosiderin. High iron release from macrophages decrease hepcidin expression. Large amount of iron is released from macrophages and absorbed from enterocytes. Tranferrinbound iron is carried in excess to bone marrow and extramedullary sites of erythropoiesis. Iron is incorporated into an excess of newly formed erythrocytes. ATG: autophagy. Dashed lines indicate iron transit
Rôle protecteur de l’inflammasome NLRP6 dans l’asthme allergique en réponse au pollen de bouleau
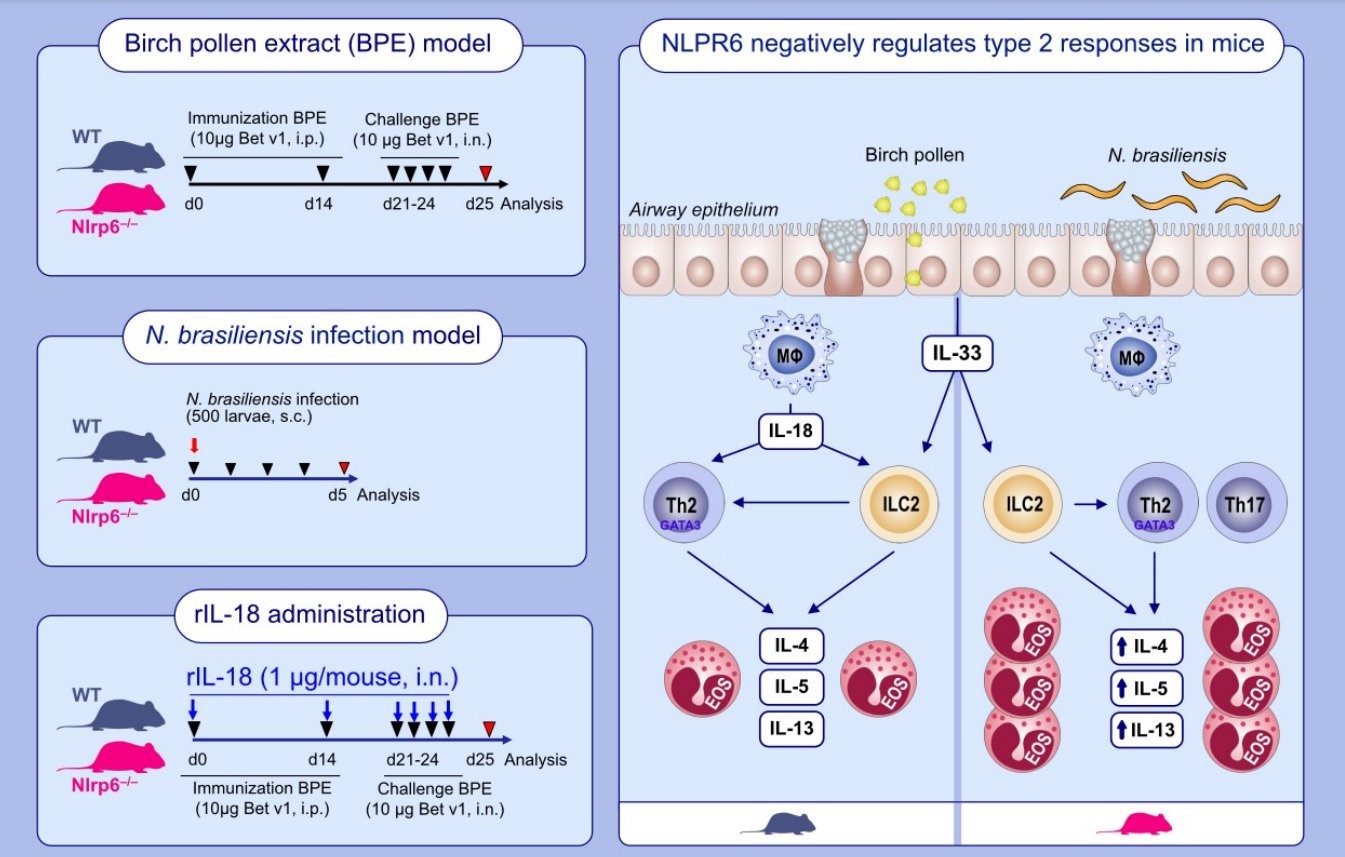
Le pollen de bouleau, un allergène environnemental entraîne forte une inflammation à éosinophiles dans les voies respiratoires et une réponse immunitaire de type 2. Il induit l’activation de l’inflammasome NLRP6 et la libération d’IL-18 mature dans le poumon. Nous avons montré que NLRP6 régule négativement les réponses immunitaires mixtes Th2/Th17 dans l’inflammation pulmonaire induites par le pollen de bouleau ou l’infection par des helminthes (Chenuet P et al, Allergy, 2022).
Mort cellulaire & inflammation pulmonaire
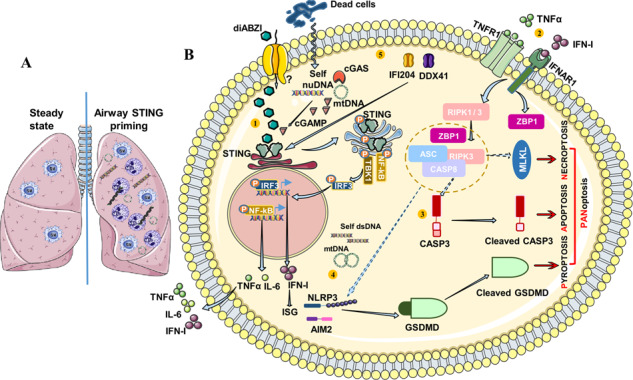
Le récepteur d’acides nucléiques STING est une cible thérapeutique en cancérologie. Nous avons caractérisé l’effet de l’agoniste synthétique de STING diABZI dans les poumons. diABZI induit une inflammation pulmonaire neutrophilique et une mort cellulaire par pyroptose, apoptose et nécroptose appelée PANoptose (Messaoud-Nacer Yasmine et al, Cell death & disease, 2022).
Résultats antérieurs
Rôle de la mort cellulaire, de la libération d’ADN du soi comme signal de danger et de la réponse interférons de type 1 lors d’une inflammation pulmonaire stérile.
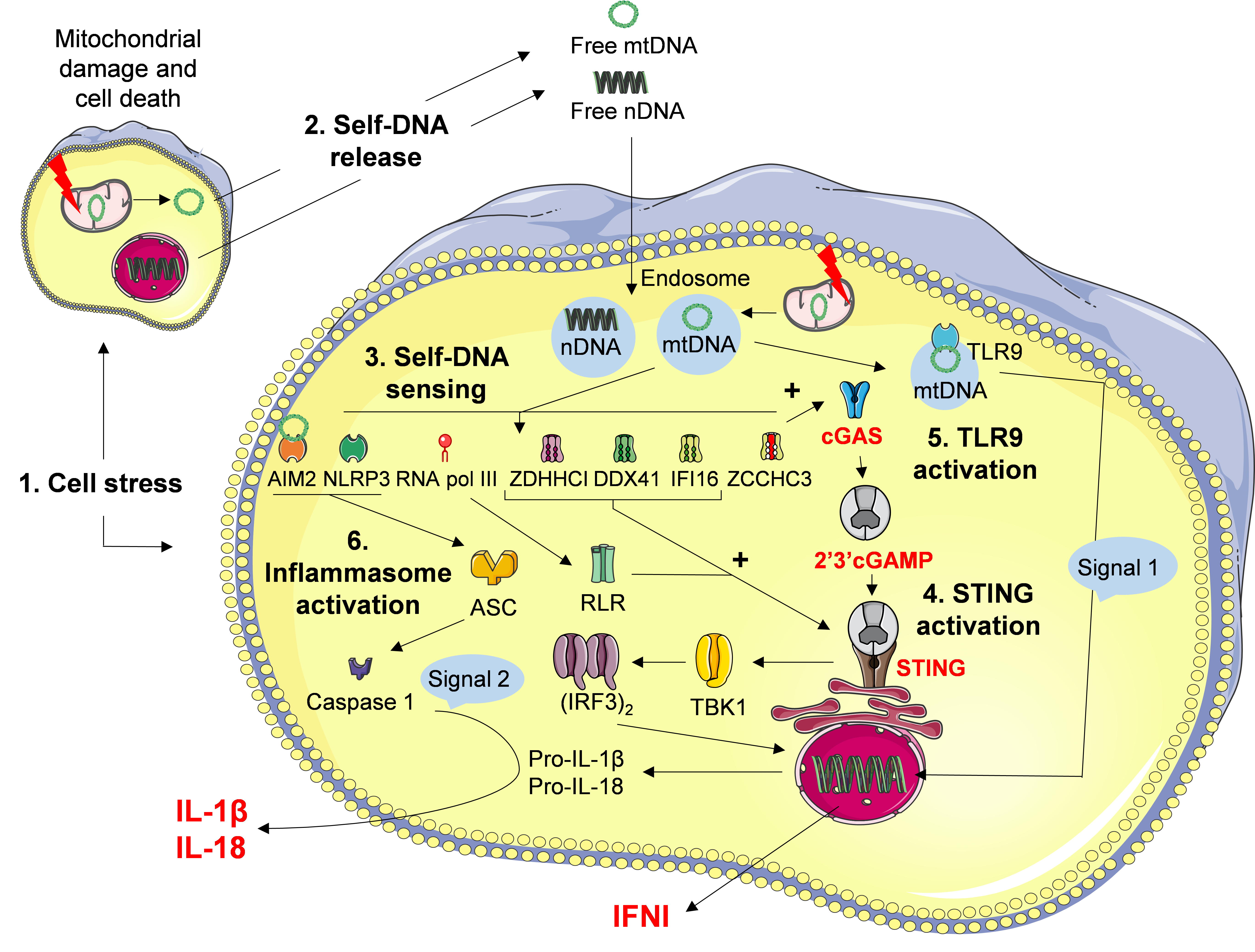
Nous avons montré le rôle de senseurs de l’ADN, en particulier de cGAS (cyclique GMP-AMP synthase) et STING (stimulator of interferon genes), après reconnaissance de l’ADN du soi libéré suite à la mort cellulaire provoquée par l’exposition à la silice. Cette activation se traduit par la mise en place d’une réponse inflammatoire et par la sécrétion d’interférons de type 1 (IFN-I) (Benmerzoug et al., Nature Com 2018; Trends Immunol 2019; Togbe et al., Allergy 2020). D’autre part, nous avons montré que l’exposition à la silice, en induisant mort cellulaire, libération d’ADN et activation de la voie STING, stimule une réponse IFN-I qui polarise la réponse immunitaire de l’hôte vers des réponses M2 et Th2 délétères pour le contrôle de l’infection mycobactérienne (Benmerzoug et al., Cell Rep 2019).
Mécanismes de l’inflammation pulmonaire induite par l’exposition à l’ozone
Nous avons caractérisé le rôle de l’IL-33 et des cellules lymphoïdes innées (ILC) dans les réactions inflammatoires pulmonaires induites par l’ozone, un polluant environnemental atmosphérique très réactif (Michaudel et al., JACI 2018). Nous avons également montré l’activation des récepteurs AhR (Aryl Hydrocarbon Receptor) par l’ozone, induisant une réponse IL-22 protectrice (Michaudel et al., Front Immunol 2020).
Neuro-inflammation : nouveau rôle des médiateurs IL-33 et acétylcholine
L’IL-33 est fortement exprimée dans le cerveau et nous avons étudié son rôle dans les aspects cognitifs associés à la malaria cérébrale notamment (Reverchon et al. PLoS Pathogen 2017; Reverchon et al., J Neuroinflam 2020).
Suite à l’accueil du Prof. W. Horsnell (Chercheur invité Studium), de nouvelles fonctions ont été identifiées pour l’acétylcholine (neuromédiateur classiquement considéré dans les interactions neuromusculaires causant la résistance pulmonaire lors d’allergie). Nous avons identifié les ILC3 comme source d’acétylcholine centrales pour la promotion de la réponse allergique pulmonaire dans un modèle d’asthme induit par la papaïne (Darby et al., JACI 2020). Les ILC2 produisent aussi l’acétylcholine, qui favorise leur expansion, pour une induction optimale de l’immunité de type 2, et contribuent à l’immunité de la muqueuse contre les parasites (Roberts et al, Sci Immunol 2021).
Microbiote et inflammation
Les effets du microbiote sur l’inflammation intestinale induite par Toxoplasma gondii, a été étudié à l’aide de modèles murins en conditions classiques ou axéniques (dépourvus de flore microbienne), et le rôle de l’IL-22 mis en évidence dans ces conditions (Couturier-Maillard et al., Mucosal Immunol. 2018). L’influence d’une souche probiotique a été testée sur l’inflammation pulmonaire induite par la papaïne, allergène protéasique (Sécher et al., Sci Rep 2018).
Certaines souches de probiotiques réduisent la réponse inflammatoire dans des modèles de colite en modulant la maturation des cellules dendritiques (Hrdy et al., Sci Rep 2020).
Nous avons montré que le microbiote contenu dans les fèces d’acariens produit des muropeptides détectés par le récepteur NOD1 des cellules épithéliales de l’hôte et aggrave la sévérité de la réponse asthmatique (Ait Yahia, JACI 2021).
Neuroinflammation
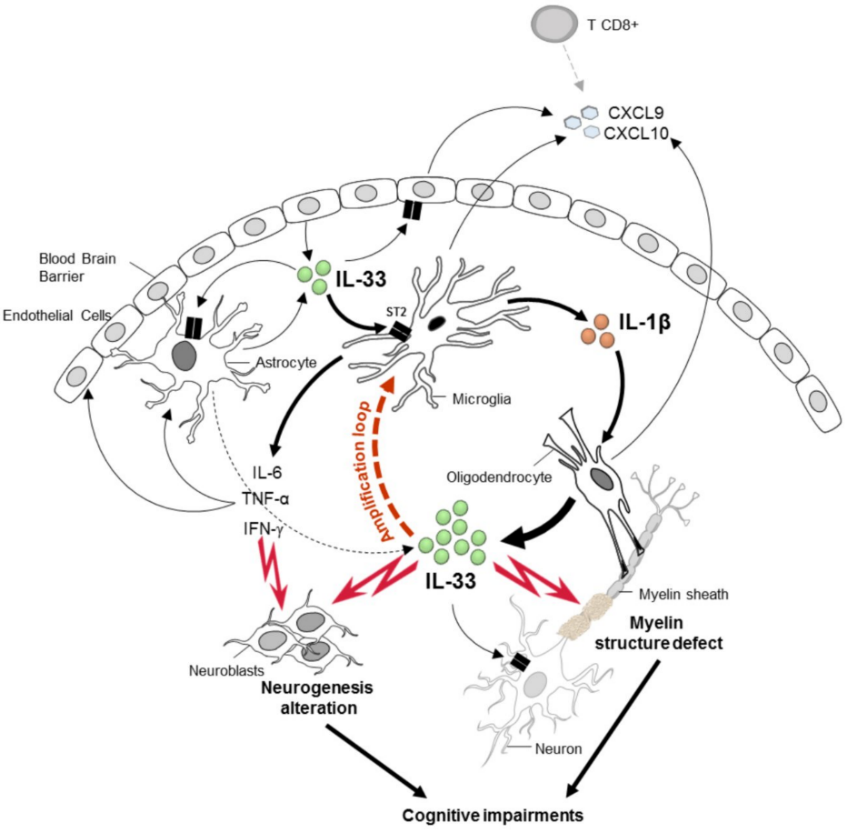
L’IL-33, fortement exprimée dans le cerveau, contribue à la pathogenèse de la malaria cérébrale par son récepteur ST2 (Palomo et al., EJI 2015). Le rôle de l’IL-33 dans une boucle inflammatoire endogène au CNS et son rôle dans les déficits cognitifs associés à l’infection par Plasmodium berghei Anka ont été mis en évidence (Reverchon et al., PLoS Pathogens, 2017; J Neuroinflam, 2020).
Mots clés récents : Allergie, ILC, IL-33, DNA du soi, senseurs d’acides nucléiques, STING, cGAS, ozone, neuromédiateurs.